
La famille de Laocoon en proie à des doubles hélices d’ADN. ©Wellcome Trust Limited 1990 , CC BY
L’édition génomique humaine consiste à modifier de façon ciblée le génome humain. Ses applications potentielles, notamment thérapeutiques, sont nombreuses. Mais alors que plusieurs réalisations existent déjà, les discussions scientifiques, médicales et éthiques vont bon train.
Ainsi, un congrès mondial sur l’édition génomique a eu lieu à Londres début mars, et la première thérapie génique basée sur les modifications ciblées du génome pourrait être validée cette année par la Food and Drug Administration américaine. Cette thérapie vise la drépanocytose, une maladie sanguine génétique « rare », qui affecte des millions de personnes à travers le monde. Là où les précédentes thérapies ont connu peu de succès, la nouvelle thérapie pourrait se montrer plus efficace.
L’édition génomique soulève de nombreux enjeux, qui rappellent les discussions sur l’ADN recombinant à la conférence d’Asilomar en 1975, ou ceux sur le clonage suite à la naissance de Dolly le mouton en 1996. Concentrons-nous sur trois de ces enjeux, particulièrement saillants dans les discussions actuelles : la question de l’héritabilité des modifications du génome humain, celle de la régulation, et celle de l’équité dans l’accès aux thérapies géniques.
Peut-on éditer le génome de ses descendants ?
Il faut distinguer deux champs dans l’édition génomique humaine. D’un côté, il y a les recherches sur les cellules « somatiques », des cellules qui ne sont pas héréditaires. De l’autre, il y a des recherches sur des cellules germinales, qui portent l’information qui est transmise à la génération suivante. Les recherches sur ces cellules « héréditaires » soulèvent d’autres types de questions, souvent plus complexes, car elles auront des effets sur la descendance d’un individu.
En effet, en ce qui concerne l’édition du génome humain héréditaire, la sûreté et l’efficacité des techniques n’ont pas encore été démontrées, un débat sociétal fait défaut, tout comme une gouvernance responsable sur le sujet. La communauté scientifique estime actuellement que les conditions ne sont pas remplies pour éditer des cellules héréditaires.
Reconstruction 3D d’un blastocyste de souris (embryon de 3-4 jours). Les cellules sont encore pluripotentes et peuvent se différencier, notamment en cellules germinales. Agnieszka Jedrusik and Magdalena Zernicka-Goetz, Gurdon Institute, CC BY
L’édition génomique de cellules somatiques, par contre, pose moins de problèmes éthiques, politiques et techniques et son futur s’annonce plus prometteur. Ainsi, les scientifiques explorent différents sujets, comme les maladies du cœur et des muscles, l’ingénierie de cellules donneuses pour éviter leur rejet par le système immunitaire d’un hôte, des maladies comme l’hémophilie B, les mucopolysaccharidoses ou encore la Beta-thalassémie. En tout, plusieurs centaines de patients sont engagés dans des protocoles expérimentaux. L’édition génomique a le potentiel de guérir des maladies jusqu’ici incurables.
À cet engouement pour les applications s’ajoute un enthousiasme pour la technologie elle-même. C’est en 2012 que CRISPR-Cas9, la plus célèbre des techniques d’édition génomique, commence à être utilisée. Depuis, son efficacité et sa précision ont été continuellement améliorées.
De plus, d’autres techniques sont dorénavant utilisées, comme le base editing ou le prime editing, qui promettent encore plus de précision. Les scientifiques espèrent, à terme, pouvoir éviter les effets dits off-target (c’est-à-dire hors du gène visé). Mais aussi ceux, moins connus, qui posent des problèmes sur la cible (effets on-target) et montrent que les effets de CRISPR-Cas9 sont « plus chaotiques que prévu ».
Les « bébés CRISPR » : une controverse toujours chaude et une régulation qui reste fragile
Malgré cet engouement, difficile d’oublier le trouble-fête majeur dans le champ de l’édition génomique : He Jiankui. Son annonce, via des vidéos postées sur YouTube fin novembre 2018, de la naissance de deux jumelles dont il avait modifié le génome à l’état d’embryon par édition génomique, avait créé une onde de choc au sein et au-delà de la communauté scientifique. « Irresponsable », « illégal », « pas éthique » : la condamnation de la communauté scientifique de l’expérimentation fut unanime et immédiate. En qualifiant l’expérience de He ainsi, ce travail de démarcation – on peut même parler d’excommunication – était un moyen pour la communauté scientifique de réaffirmer et de protéger son autorité morale, et de rassurer la communauté scientifique, tout comme le public.
Cinq ans plus tard, la controverse causée par He Jiankui n’est pas éteinte. Au troisième sommet international sur l’édition génomique humaine, qui se tenait à Londres du 6 au 8 mars 2023, les scientifiques rappelaient ces travaux, évoquant un événement « dramatique » et rappelant comment l’annonce de He Jiankui « dominait » les discussions en 2018 (Robin Lovell-Badge, organisateur du sommet londonien). David Baltimore, prix Nobel, co-organisateur des deux premiers sommets, soulignait que probablement la « régulation internationale avait échouée », tout en rassurant qu’il s’agissait d’un « événement singulier qui ne s’est jamais reproduit depuis » (notons toutefois que Denis Rebrikov avait annoncé son intention d’éditer des embryons humains en 2019 et que des recherches sur des embryons humains excédentaires provenant de cliniques de fécondation in vitro sont en cours).
Une session entière du sommet à Londres fut par conséquent dédiée à la question de la régulation en Chine. Un membre de l’Académie des Sciences Chinoise (Yaojin Peng) présentait les lois, régulations et codes éthiques en la matière. Tout en expliquant que le pays avait « accéléré » et « amélioré » la régulation, il soulignait que l’édition génomique héréditaire est légalement interdite et que la Chine est fondamentalement « conforme » aux normes internationales. La présentatrice suivante (Joy Zhang, sociologue à l’Université du Kent) se montrait moins optimiste. Malgré la bienvenue de discussions sur la sécurité et l’éthique, celles-ci ne s’appliqueraient qu’à la médecine et à la science publique, mais pas aux entreprises. En Chine, la participation des scientifiques dans les prises de décisions – ces premiers demandant plus de transparence et de débat public – reste un processus « fragile » selon Zhang.
Si l’édition de cellules germinales est techniquement possible, elle est éthiquement, politiquement et légalement problématique, d’où les débats actuels sur sa régulation. En Europe, la convention Oviedo (Convention pour la protection des droits de l’homme et de la dignité de l’être humain à l’égard des applications de la biologie et de la médecine) l’interdit. Au niveau mondial, aucun pays ne semble l’autoriser, trois quarts des pays l’interdisent, et seulement trois pays ont des positions indéterminées sur le sujet (Burkina Faso, Singapour, Ukraine).
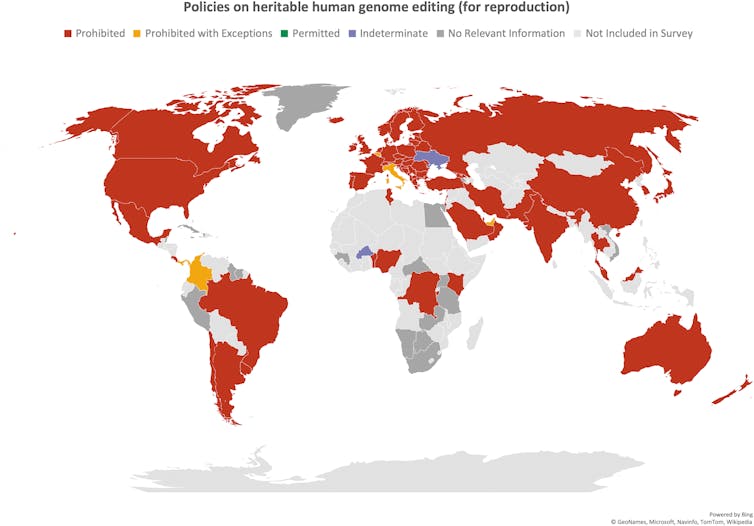
Les politiques publiques sur l’édition du génome humain « héritable » à des fins reproductives (rouge : interdit ; orange : interdit avec exceptions ; vert : permis ; violet : indéterminé ; gris foncé : pas d’informations pertinentes ; gris clair : non inclus dans l’étude). Françoise Baylis et coll. 2020 ; Published by Mary Ann Liebert, Inc, CC BY
À la fin du sommet cette année, on sentait malgré cela une certaine frustration de la part des organisateurs : « Souvenez-vous que ce sommet a beaucoup porté sur l’édition génomique de cellules somatiques et tout l’engouement qu’elle suscite. Alors, où sont les questions à ce sujet ? » demandait Robin Lovell-Badge.
Quel accès et quels prix pour les thérapies géniques ?
Revenons donc à l’utilisation de l’édition génomique pour les thérapies géniques.
La thérapie génique est une stratégie thérapeutique qui consiste à introduire du matériel génétique afin de traiter une maladie, soit en prélevant, transformant et réinjectant des cellules au patient (méthode ex vivo), soit en introduisant directement le vecteur dans un tissu (méthode in vitro). Ce processus est cependant complexe et de nombreux essais cliniques ont connu des échecs dans le passé.
Le développement de thérapies géniques nécessite des investissements conséquents, ce qui soulève la question de l’équité et de l’accès aux traitements. Nombreux sont ceux qui pointent du doigt les prix très élevés de certains produits existants : il faut dépenser plusieurs millions d’euros pour certaines thérapies géniques (comme Zolgensma ou Libmeldy).
D’où la nécessité de réfléchir à la régulation des prix ou à des modèles alternatifs non commerciaux (philanthropie, consortiums entre acteurs universitaires, licences dites « humanitaires »). Les associations de patients ont un rôle important à jouer ici, car elles ne s’intéressent pas seulement au développement de ces thérapies, mais « s’attaquent à leurs obstacles économiques et explorent des solutions qu’elles jugent souhaitables ou justes pour les patients et la société dans son ensemble ».
L’arrivée sur le marché américain d’un traitement contre la drépanocytose soulève de nombreuses questions : « Je ne sais pas comment on peut créer des prix, des payements, des innovations dans la propriété intellectuelle […]. Un traitement pour la drépanocytose arrive cet été, mais personne n’est prêt » estimait Steve Pearson, président du Institute for Clinical and Economic Review, lors du sommet à Londres.
Des prix trop élevés pour les thérapies géniques entraînent le risque d’un « eugénisme technique ». Comment éviter que le traitement ne soit seulement accessible aux plus riches ? Comment assurer une équité au niveau international et que le traitement soit abordable dans les régions du monde où la maladie est fréquente (Afrique subsaharienne, Antilles, Brésil, Inde) ?
L’édition génomique humaine soulève donc toute une panoplie de questions : scientifiques, éthiques, politiques, sociétales, réglementaires, économiques et démocratiques.
Face à ces enjeux, il faudra trouver des réponses plus concrètes en matière de gouvernance et de régulation. Comment traduire des principes comme la responsabilité, la transparence, l’accessibilité, l’équité, l’inclusion, et le dialogue sociétal en impératifs politiques ? Comment, en gros, prendre la politique de la génétique au sérieux ? L’enjeu est de taille.![]()
Morgan Meyer, Directeur de recherche CNRS, sociologue, Mines Paris
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.


