Les premières semaines de la vie d’un embryon humain sont cruciales pour le développement futur de l’individu. Comment se déroulent les premiers instants de la vie embryonnaire chez l’humain ? Quels sont les modèles qui nous permettent de les étudier ? Les modèles animaux, comme la souris, sont utilisés mais diffèrent significativement. Les organoïdes, qui imitent partiellement les organes humains, ne reflètent pas toute la complexité du développement d’un embryon. En 2022, deux équipes créaient des embryons de souris, indépendamment de toute fécondation. Début septembre 2023, une équipe israélienne annonçait la réalisation à partir de cellules souches d’un embryon de synthèse ou embryoïde humain, comparable à un embryon humain de 13 à 14 jours.
Le développement se déroule selon une séquence établie d’événements finement orchestrés, qui conduit à partir d’une cellule à la formation d’un individu constitué de 10 à 100 mille milliards de cellules. Si ces premières semaines se déroulent selon un plan robuste, l’embryon reste vulnérable. La moindre altération de ces étapes peut conduire à des avortements spontanés ou à des malformations sévères du fœtus. Les avortements spontanés représentent une part importante des développements qui échouent, estimés à 70 % des fécondations. La plupart de ces pertes surviennent avant l’implantation de l’embryon dans l’utérus, ou avant la fin du cycle menstruel, à un stade où le nombre de cellules contenues dans l’embryon varie de 100 à 200 cellules ; de nombreux avortements spontanés passent donc totalement inaperçus.
En quatre semaines, les cellules se multiplient, se déplacent pour s’organiser en tissus, se différencient et fonctionnent de manière spécialisée. Plusieurs questions restent en suspens et interrogent la compréhension de ces processus complexes : quels sont les mécanismes précis qui contrôlent la différenciation cellulaire et l’organisation des tissus ? Une autre question clé est de comprendre les influences génétiques et environnementales spécifiques qui conduisent aux anomalies. Ces inconnues compliquent notre compréhension des avortements spontanés et des pathologies embryonnaires, comme des pertes de fonction cellulaire ou des malformations.
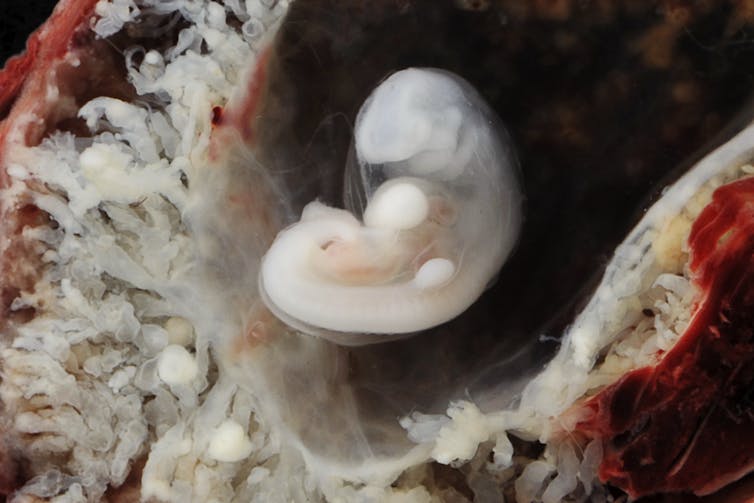
Embryon de 3 à 4 semaines (0,5 cm de longueur). Lunar Caustic, CC BY
Quand deux cellules se reconnaissent pour ne faire qu’une
Lors de la fécondation, un spermatozoïde et un ovule fusionnent pour former une cellule unique, ou zygote. Cette étape initiale se déroule dans l’une des trompes de Fallope, ou oviducte. Comment les deux cellules se reconnaissent-elles et se dirigent-elles l’une vers l’autre ? Lorsqu’il est expulsé de l’ovaire, l’ovule voyage dans l’oviducte. Mus par leurs flagelles et guidés par des récepteurs présents à leur surface, les spermatozoïdes sont attirés vers l’ampoule de la trompe de Fallope, où existe une subtile différence de température, et vers l’ovule, grâce à une concentration croissante de molécules spécifiques.
Les deux cellules doivent ensuite se reconnaître mutuellement afin que leurs membranes fusionnent et que leurs matériels génétiques s’organisent pour une première division cellulaire. Deux protéines jouent des rôles essentiels dans ce mécanisme de reconnaissance et de fusion : Izumo et Juno sont présentées respectivement à la surface du spermatozoïde et de l’ovule. Si l’une des deux protéines est absente ou non fonctionnelle, la reconnaissance mutuelle ne s’effectue pas et la fécondation ne peut pas avoir lieu. Une fois cette interaction réalisée, Juno est rapidement éliminée de la surface de l’ovule pour empêcher d’autres spermatozoïdes de pénétrer.
Toute altération de la structure de ces cellules, de leur génome, de leurs capacités de mobilité ou de reconnaissance mutuelle est à l’origine, entre autres, de nombreux problèmes de stérilité humaine.
De la division cellulaire à l’implantation utérine
Après la fécondation, les cellules se multiplient par mitose et forment une sphère creuse, ou blastocyste. Au cours des premières divisions cellulaires, l’embryon s’appuie progressivement sur l’expression de son propre génome, une transition risquée en cas d’anomalies génétiques graves.
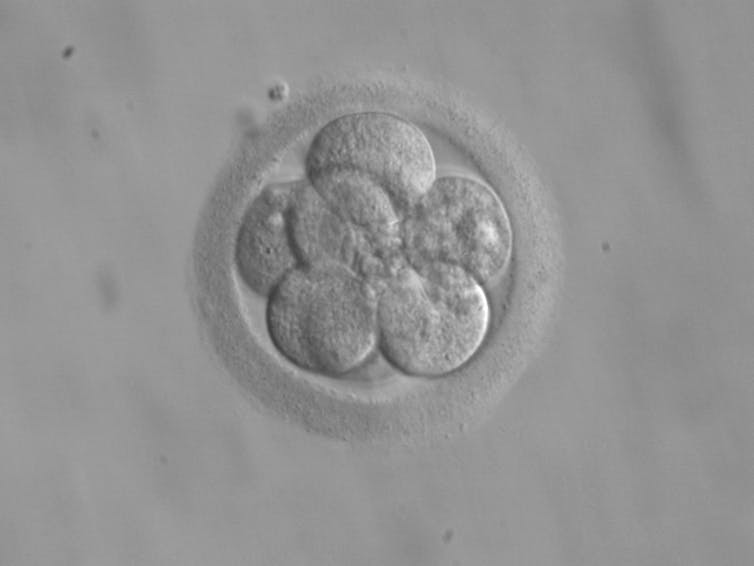
Embryon humain au stade 8 cellules, entouré d’une couche glycoprotéique, la zone pellucide. CC BY
Dans le blastocyste, les cellules présentes s’organisent en deux catégories : des cellules qui forment une masse renflée ou bouton embryonnaire, à l’origine de tous les organes de l’embryon, et des cellules périphériques, qui participeront à l’implantation de l’embryon dans l’utérus et au placenta, structure vitale à la survie de l’embryon.
Si les étapes de la fécondation et les divisions cellulaires peuvent être étudiées in vitro, les étapes du développement ultérieures et la viabilité de l’embryon dépendent de l’implantation de ce dernier dans la muqueuse utérine. Durant cette période, l’embryon présente une grande vulnérabilité, étant exposé aux agents pathogènes tels que les virus. L’implantation a donc constitué un premier « obstacle » à l’observation expérimentale du développement précoce, obstacle repoussé à 14 jours, qui constitue la limite légale de culture dans la majorité des pays.
Quand la gastrulation échoue
La gastrulation se déroule au cours de la troisième semaine de grossesse : elle organise les trois axes de l’embryon (antérieur-postérieur, dorsal-ventral et droite-gauche), en mettant en place trois feuillets cellulaires à partir desquels seront organisés le plan du corps et tous les tissus de l’organisme. La structure principale mise en place à ce stade est la ligne primitive. Elle instaure une structure axiale qui induira la formation du système nerveux. L’embryon prend forme grâce à de multiples mouvements cellulaires, dont des mouvements de migration ou de « repli » qui donneront naissance à une nouvelle cavité : le tube digestif.
Que se passe-t-il quand la gastrulation échoue ? Outre des avortements spontanés, plusieurs malformations congénitales ont été associées aux anomalies de gastrulation ou des premières étapes de l’organogenèse : défauts de fermeture de la colonne vertébrale, malformations intestinales, faciales ou cardiaques. Ces malformations ont des conséquences graves sur la santé de l’enfant, entraînant des complications importantes.
Embryoïdes et embryons de synthèse, de quoi parle-t-on ?
De larges pans de la régulation moléculaire de ces événements restent méconnus, car des étapes, comme la gastrulation ou le début de l’organogenèse, demeurent difficiles à étudier. La limite de culture des embryons humains est éthiquement fixée à 14 jours, ce qui interdit toute étude in vitro au-delà. Elle correspond à la fin de l’implantation dans l’utérus. Au cours de la troisième semaine, l’embryon humain développe la ligne primitive, structure clé pour l’induction et la formation du système nerveux central. Le développement de ces structures, associées à une forme de sensibilité ou de potentiel de vie humaine, marque l’acquisition d’un statut moral protégeant l’embryon de toute recherche.
De nouveaux modèles sont venus ouvrir des perspectives d’étude : les embryoïdes se forment à partir d’un agrégat de cellules souches, qui s’organisent et présentent des similitudes de structure et de développement avec un embryon. Ces embryoïdes sont capables de s’auto-organiser, de « sentir » leur environnement, de s’adapter et montrent des niveaux de complexité supérieurs à ceux des organoïdes, versions simplifiées d’un organe in vitro.
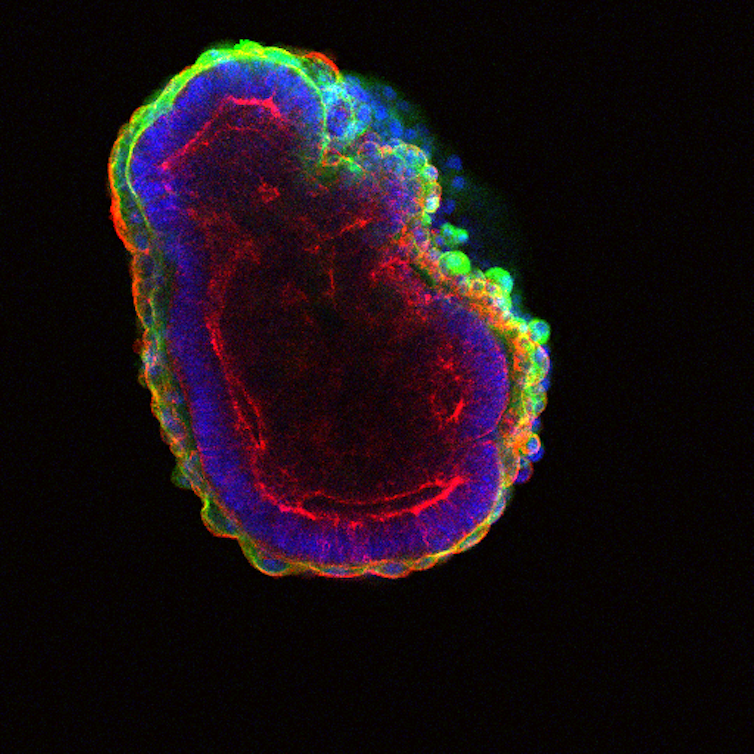
Embryoïde de souris (immunofluorescence). Les noyaux sont colorés en bleu. L’actine, élément du cytosquelette, est colorée en rouge. La laminine, à la base des cellules des tissus épithéliaux, est en vert. La laminine est une protéine qui joue un rôle essentiel dans l’adhérence cellulaire, la différenciation, la migration et l’organisation des tissus. Ekem/Wikimedia, CC BY
Ces embryoïdes sont parfois appelés « embryons synthétiques », mais le terme d’embryon semble trompeur puisque ces modèles ne sont pas capables de former des organismes vivants. Par ailleurs, le terme « synthétique » est discutable, dans la mesure où le développement observé, résultant de dialogues cellulaires et moléculaires, n’est pas stimulé de manière artificielle. En outre, les assemblages de cellules souches de mammifères, appelés blastoïdes, gastruloïdes ou embryoïdes, recouvrent des réalités différentes. Ils ne reflètent pas nécessairement et fidèlement les mécanismes du développement embryonnaire et sont plus comparables à des ébauches partielles d’embryons qu’à des embryons à part entière. Les travaux qui emploieront ces embryoïdes seront fondamentaux, en matière d’applications thérapeutiques ultérieures.
Les embryoïdes posent d’importants défis éthiques. Constituent-ils vraiment des alternatives plus éthiques à l’utilisation des embryons humains ? Quel est le statut moral de ces structures, qui imitent certaines caractéristiques d’un embryon « naturel », mais ne résultent pas de la fusion d’un spermatozoïde et d’un ovule ? À partir de quel moment une masse de cellules peut-elle être considérée comme un être à part entière ? Quelles limites poser à leurs usages, en particulier si ces embryons en viennent à pouvoir atteindre un stade avancé de développement cellulaire au-delà de la deuxième semaine ?
La culture des embryons in vitro au-delà de la limite des 14 jours était également très difficile techniquement à dépasser. Les techniques décrites notamment grâce à l’étude des embryoïdes permettent de repousser cette limite. De nombreux pays réévaluent donc cette limite, ce qui autoriserait l’étude de la période dite de la « boîte noire » du développement embryonnaire, qui s’étend actuellement du 14e jour jusqu’au début du deuxième mois.
Le Conseil d’orientation de l’Agence de la biomédecine a notamment proposé, en 2023, d’autoriser les recherches jusqu’à un stade équivalent au 28e jour du développement embryonnaire, tout en maintenant l’interdiction d’implantation in vivo et en excluant les exploitations commerciales. Une voie réglementaire spécifique pour les modèles embryoïdes, entre les cellules souches et les embryons, est nécessaire.![]()
Jean-François Bodart, Professeur des Universités, en Biologie Cellulaire et Biologie du Développement, Université de Lille


